原文链接:Does the BOLD response result from the firing of nerve cells?
- 概要

是的,虽然是间接的。神经活动增加导致局部血流量,血容量和需氧量的增加,此过程称为神经血管偶联。产生神经血管偶联的生理学机制在下面的高级讨论中有更详细的描述。
虽然BOLD信号确实与“放电”的神经细胞数目相关,但与细胞外的局部场电位(Local Field Potentials,LFPs)关系更紧密。LFPs记录的是大量脑细胞在一个较长时间过程中缓慢变化的电压,比去极化的“尖峰”时间长得多。LFPs反映了局部神经网络的活动总和,不仅包括神经元放电也包括在多个树突连接处的正的和负的突触后电位的总和。
一个短暂的外周刺激(如激光或针刺)产生的局部BOLD响应称为血流动力学响应函数(Hemodynamic Response Function,HRF),HRF一般会在开始有一个小的下冲,紧跟着是一个很高的尖峰,然后是刺激后的过冲(可有可无)。
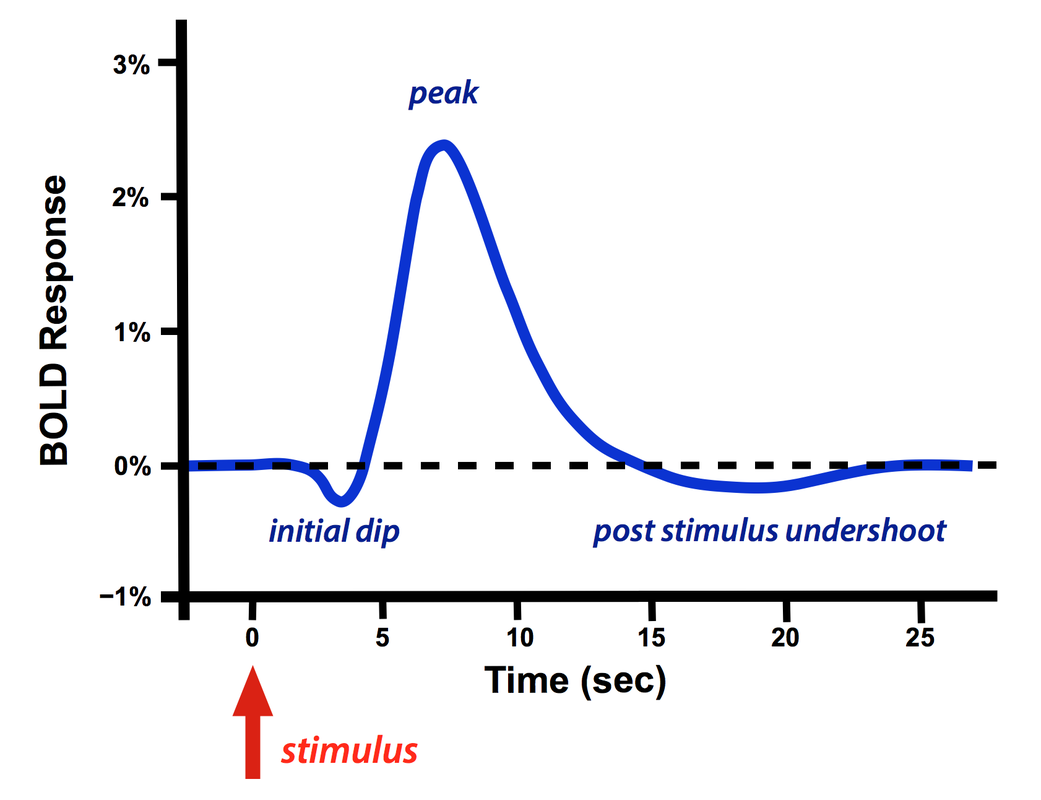
一个短暂的刺激之后BOLD的血流动力学响应函数(HRF)
初始的下冲并不总是会出现,一般在非常高的场强(≥ 7.0T)下更多见。它的形成机制仍然存在争议,主要有两个流行的理论,a)血氧早期代谢的增加和/或b)局部脑血容量的增加。此下冲吸引人的地方在于大脑激活时它可以比大的尖峰提供更高的空间特异性。
正向主峰是BOLD响应的主体,很快就盖过了小的初始下冲,在此阶段局部脑血流量不成比例的增加,远超过直接的代谢需要,造成的结果就是血红蛋白对去氧血红蛋白的比例短时增加,MR信号增强。即使是一个非常短暂的刺激,主导地位的HRF响应也非常缓慢而且有延迟,通常在5-15秒之后才发生。
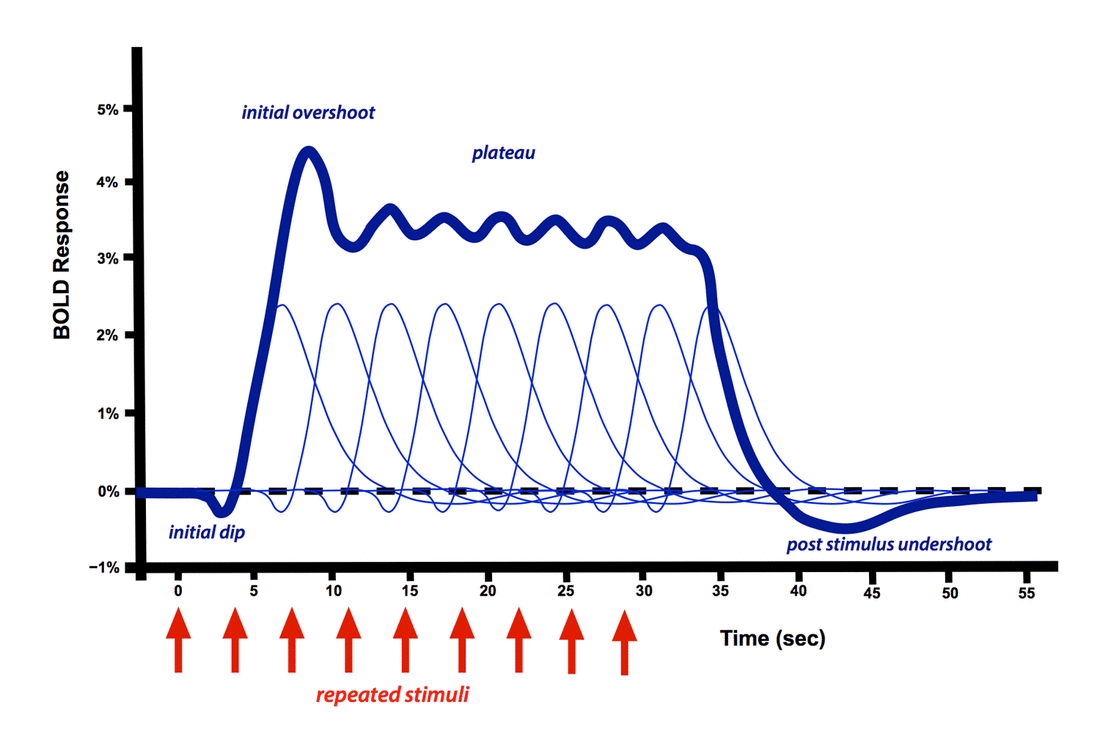
刺激后过冲也不总是会出现的,通常出现在长时间刺激实验中,它的机制也存在争议,但很可能是由于动脉血容量恢复缓慢和刺激晚期脑状态相关的局部脑血流量减少导致的。
如果多个重复的刺激间隔时间超过4-5秒,它们会以近似线性的方式叠加在一起,当施加了一长串的重复刺激,响应的主峰就变成广阔的高原,不会衰减直至刺激结束。有时可以观察到小的初始过冲,当然不同的被试,不同的实验条件,检查不同的脑区都会导致HRF的可观变化。
关于HRF和BOLD响应的更多细节可以在左边的短片中看到(视频来自YouTube www.youtube.com/embed/jG2WQpgpnMs?wmode=opaque, 不能播放)。
高级讨论
神经血管偶联
神经血管偶联指的是神经元活动导致的局部血流量,血容量和氧摄取量变化的过程。尽管有一个多世纪的大量研究,对这种现象背后的机制仍知之甚少,尚没有达成科学共识。
代谢需要 大脑有很高的能量需求,大约消耗了整个身体20%的氧气,其中至少一半的能量与突触传递有关,包括突触后受体引起的离子通量逆转和谷氨酸的回收。BOLD响应过程中初始的过量血供和氧和过度超过了直接的代谢需求。这意味着后期血供是用于给神经元和相关的支持细胞(星形胶质细胞/周皮细胞)补充能源供应而不是参与最初的响应过程。葡萄糖的供应而不是氧才是最重要的因素。
血管活性物质 神经元活动会释放大量的离子和小分子,它们是有血管活性的,包括离子(Ca++, K+, Na+),腺苷,一氧化氮(NO),血管活性肠肽(VIP),神经肽Y(NPY),前列腺素,谷氨酸,乙酰胆碱和去甲肾上腺素。
血管舒张的传播 血管内自身的信号机制受内皮源性超极化因子(EDHF),前列腺素,和/或一氧化氮的介导,目前正在探索它们对血流动力学反应的贡献。
神经元之外的细胞(星形胶质细胞和周皮细胞)介质 神经胶质细胞大约是神经元数量的10倍,占大脑容积的一半儿以上。它们在脑血管调节,神经代谢调节和神经递质摄取,很可能也包括BOLD信号上都发挥了重要作用。特别是星形胶质细胞,由于其与神经元和血管之间独特的位置,现在受到很多的关注。目前流行的(但未经证明)“星形胶质细胞-神经元乳酸穿梭”学说认为星形胶质细胞为神经元提供乳酸作为对谷氨酸水平升高的能量底物。
神经元活动和BOLD的去偶联
偶然情况下,BOLD信号可能与神经元活动不再偶联。一个经常被引用的例子是提早发生的血管扩张现象,此种情况下BOLD信号会先于预期的重复刺激增大。另一个例子涉及GABAA兴奋剂印防己毒素的注射,此时动作电位峰值升高但局部脑血流量没有变化。
- 参考材料
- Bandettini PA, Wong EC, Hinks RS, et al. Time course EPI of human brain function during task activation. Magn Reson Med 1992; 25:390–397.
- Blamire AM, Ogawa S, Ugurbil K, et al. Dynamic mapping of the human visual cortex by high-speed magnetic resonance imaging. Proc Natl Acad Sci USA 1992; 89:11069–11073. (first demonstration of the single HRF from a short stimulus versus plateau-type response from much longer stimuli).
- Buckner RL. Event-related fMRI and the hemodynamic response. Human Brain Mapping. 1998; 6:373–377. (shows linear response to short-term stimuli)
- Chen JJ, Pike GB. Origins of the BOLD post-stimulus undershoot. Neuroimage 2009; 46:559-568.
- Ekstrom A. How and when the fMRI BOLD signal relates to underlying neural activity: the danger in dissociation. Brain Res Rev 2010; 62:233-244.
- Figley CR, Stroman PW. The role(s) of astrocytes and astrocyte activity in neurometabolism, neurovascular coupling, and the production of functional neuroimaging signals. Eur J Neurosci 2011; 33:577-588. (Astrocytes outnumber of neurons by 10:1 and comprise about half of total brain volume. They play an important role in cerebrovascular regulation, neurometabolic regulation, neurotransmitter uptake, and quite possibly the BOLD fMRI signal)
- Fox PT. The coupling controversy. Neuroimage 2012; 62:594-601.
- Fox PT, Raichle ME. Focal physiological uncoupling of cerebral blood flow and oxidative metabolism during somatosensory stimulation in human subjects. Proc Natl Acad Sci USA 1986; 83:1140-1144. (Famous paper destroying the once-popular myth that CBF and metabolic rate of oxygen consumption were tightly linked).
- Harris JJ, Jolivet R, Attwell D. Synaptic energy use and supply. Neuron 2012; 75:762-777. (Good review showing that over half of brain energy is used for synaptic transmission).
- Hillman EMC. Coupling mechanism and significance of the BOLD signal: a status report. Annu Rev Neurosci 2014; 37:161-181.
- Logothetis NK, Pauls J, Augath M, Trinath T, Oeltermann A. Neurophysiological investigation of the basis of the fMRI signal. Nature 2001; 412:150-157. (famous paper showing better correlation of BOLD responses with LFPs rather than action potentials)
- Mullinger KJ, Mayhew SD, Bagshaw AP, Bowtell R, Francis ST. Poststimulus undershoots in cerebral blood flow and BOLD fMRI responses are modulated by poststimulus neuronal activity. Proc Natl Acad Sci USA 2013; 110:13636-41.
- Phillips AA, Chan FHN, Zheng MMZ, et al. Neurovascular coupling in humans: physiology, methodological advances and clinical implications. J Cereb Blood Flow Metab 2015; Epub http://dx.doi.org/10.1177/0271678X15617954
- Shmuel A, Augath M, Oeltermann A, Logothetis NK. Negative functional MRI response correlates with decreases in neuronal activity in monkey visual area V1. Nature Neurosci 2006; 9:569-577. (description of the negative BOLD response)
- Sirotin YB, Das A. Anticipatory haemodynamic signals in sensory cortex not predicted by local neuronal activity. Nature 2008; 457:475-479, corrected 5 Feb 2009. (showed that vasodilation may bring additional arterial blood to cortex locally in anticipation of expected tasks)
- 相关问题